Page 36 - 《广西植物》2025年第6期
P. 36
1 0 2 2 广 西 植 物 45 卷
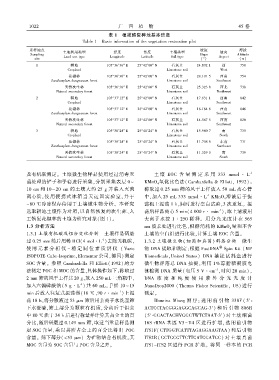
表 1 植被恢复样地基本信息
Table 1 Basic information of the vegetation restoration plot
采样地点 坡度 海拔
土地利用类型 经度 纬度 土壤类型 坡向
Sampling Slope Altitude
Land use type Longitude Latitude Soil type Aspect
site (°) (m)
1 耕地 105°36′36″ E 25°42′00″ N 石灰土 24.892 1 西 758
Cropland Limestone soil West
花椒林 105°36′36″ E 25°42′00″ N 石灰土 28.101 5 西南 754
Zanthoxylum bungeanum forest Limestone soil Southwest
天然次生林 105°36′36″ E 25°42′00″ N 石灰土 25.323 8 西北 738
Natural secondary forest Limestone soil Northwest
2 耕地 105°37′12″ E 25°42′00″ N 石灰土 17.631 1 西南 842
Cropland Limestone soil Southwest
花椒林 105°37′12″ E 25°42′00″ N 石灰土 16.184 6 西南 846
Zanthoxylum bungeanum forest Limestone soil Southwest
天然次生林 105°37′12″ E 25°42′00″ N 石灰土 14.567 5 西南 820
Natural secondary forest Limestone soil Southwest
3 耕地 105°38′24″ E 25°41′24″ N 石灰土 15.980 7 南 735
Cropland Limestone soil South
花椒林 105°38′24″ E 25°41′24″ N 石灰土 11.708 6 东南 731
Zanthoxylum bungeanum forest Limestone soil Southeast
天然次生林 105°38′24″ E 25°41′24″ N 石灰土 11.329 0 南 739
Natural secondary forest Limestone soil South
及有机碳测定ꎮ 土壤微生物样品使用经过消毒灭 土 壤 EOC 含 量 测 定 采 用 333 mmol L  ̄1
菌处理的铲子和手套进行采集ꎬ分别采集表层 0 ~ KMnO 氧化比色法( Cambardella & Elliottꎬ 1992):
4
10 cm 和 10 ~ 20 cm 的土壤大约 25 g 并装入灭菌 称取过 0.25 mm 筛的风干土样放入 50 mL 离心管
离心管ꎬ使用便携式冰箱当天运回实验室ꎬ并于 中ꎬ加入 25 mL 333 mmolL KMnO 溶液后于振
 ̄1
4
-80 ℃ 冷冻保存待用于土壤微生物分析ꎮ 本研究 荡机上振荡 1 hꎬ同时进行空白试验ꎬ3 次重复ꎮ 振
选取耕地土壤作为对照ꎬ以自然恢复的次生林、人 荡后样品离心 5 min(4 000 r min )ꎬ取上清液用
 ̄1
工恢复花椒林的土壤为研究对象(图 1)ꎮ 去离子水按 1 ∶ 250 稀释ꎮ 用分光光度计在 565
1.3 分析方法 nm 波长处进行比色ꎬ根据消耗的 KMnO 量和不含
4
1.3.1 土壤有机碳及组分变化分析 土壤样品研磨 土壤的空白组进行比较ꎬ计算土壤 EOC 含量ꎮ
 ̄1 1.3.2 土壤微生物( 细菌和真菌) 群落分析 微生
过 0.25 mm 筛后用稀 HCl(4 molL )去除无机碳ꎬ
®
使用 元 素 分 析 仪 - 稳 定 同 位 素 质 谱 仪 ( Vario 物 DNA 提取和测定:根据 FastDNA Spin Kit ( MP
ISOPOTE Cube ̄IsoprimeꎬElementar 公司ꎬ德国)测定 BiomedicalsꎬUnited States) DNA 抽提试剂盒进行
SOC 含量ꎮ 参照 Cambardella 和 Elliott(1992) 的方 微生物群落总 DNA 抽提ꎬ利用 1%琼脂糖凝胶电
法测定 POC 和 MOC 的含量ꎬ具体操作如下:称取过 泳检测 DNA 质量(电压 5 Vcm ꎬ时间 20 min)ꎬ
 ̄1
2 mm 筛的风干土样共 20 gꎬ放入 250 mL 三角瓶中ꎬ DNA 浓 度 和 纯 度 使 用 紫 外 分 光 光 度 计
 ̄1
加入六偏磷酸钠(5 gL ) 共 60 mLꎬ手摇 10 ~ 15 NanoDrop2000 ( Thermo Fisher Scientificꎬ US) 进行
min 后放入往复式振荡器(18 ℃ꎬ90 rmin )上振 测定ꎮ
 ̄1
荡 18 hꎬ将分散液过 53 μm 筛后用去离子水洗至筛 Illumina Miseq 测 序: 选 用 前 引 物 338F ( 5′ ̄
下水澄清ꎬ筛上部分为颗粒有机质ꎬ分离后于铝盒 ACTCCTACGGGAGGCAGCAG ̄3′) 和 后 引 物 806R
中 80 ℃烘干 24 h 后进行称量并计算其占全土的百 (5′ ̄GGACTACHVGGGTWTCTAAT ̄3′) 对土壤细菌
分比ꎬ随后研磨过 0.149 mm 筛ꎬ取适当重量样品测 16S rRNA 基因 V3 -V4 区进行扩增ꎬ选用前引物
定 SOC 含量ꎬ乘以其所占全土的百分比得出 POC ITS1F( CTTGGTCATTTAGAGGAAGTAA) 和后引物
含量ꎮ 筛下部分( <53 μm) 为矿物结合有机质ꎬ其 ITS2R( GCTGCGTTCTTCATCGATGC) 对 土 壤 真 菌
MOC 含量为 SOC 含量与 POC 含量之差ꎮ ITS1-ITS2 区进行 PCR 扩增ꎮ 将同一样本的 PCR