Page 75 - 《广西植物》2020年第4期
P. 75
4 期 樊航等: 西番莲 PeERG 基因克隆及其表达模式分析 5 1 3
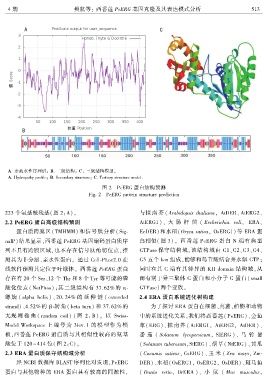
A. 亲疏水性序列谱ꎻ B. 二级结构ꎻ C . 三级结构模型ꎮ
A. Hydropathy profileꎻ B. Secondary structureꎻ C. Tertiary structure model.
图 2 PeERG 蛋白结构预测
Fig. 2 PeERG protein structure prediction
223 个氨基酸残基(图 2:A)ꎮ 与拟 南 芥 ( Arabidopsis thalianaꎬ AtDER、 AtERG2、
2.2 PeERG 蛋白高级结构预测 AtERG1 )、 大 肠 杆 菌 ( Eecherichia coliꎬ ERA、
蛋白质跨膜区( TMHMM) 和信号肽分析( Sig ̄ EcDER)和水稻(Oryza sativaꎬ OsERG1) 等 ERA 蛋
nalP)结果显示ꎬ西番莲 PeERG 基因编码蛋白质序 白相似( 图 3)ꎮ 西番莲 PeERG 蛋白 N 端有典型
列不具有跨膜区域ꎬ也不存在信号肽酶切位点ꎬ推 GTPase 保守结构域ꎬ该结构域由 G1、G2、G3、G4、
测其为非分泌、亲水性蛋白ꎮ 通过 Cell ̄PLoc2.0 在 G5 五个 box 组成ꎬ能够和鸟苷酸结合并水解 GTPꎻ
线软件预测其定位于叶绿体ꎮ 西番莲 PeERG 蛋白 同时在其 C 端有其特异的 KH domain 结构域ꎬ从
存在有 20 个 Ser、12 个 Thr 和 8 个 Tyr 等可能的磷 而有别于异三聚体 G 蛋白和小分子 G 蛋白( small
酸化位点( NetPhos)ꎻ其二级结构有 37.62% 的 α ̄ GTPase)两个亚族ꎮ
螺 旋 ( alpha helix)、 20. 24% 的 延 伸 链 ( extended 2.4 ERA 蛋白系统进化树构建
strand)、4.52% 的 β ̄转角( beta turn) 和 37.62% 的 为了探讨 ERA 蛋白在细菌、真菌、植物和动物
无规 则 卷 曲 ( random coil) ( 图 2: B)ꎮ 以 Swiss ̄ 中的系统进化关系ꎬ我们将西番莲( PeERG)、金鱼
Model Workspace 上 编 号 为 3iev. 1 的 模 型 作 为 模 草( ERG)、拟 南 芥 ( AtERG1ꎬ AtERG2ꎬ AtDER)、
板ꎬ西番莲 PeERG 蛋白质与其相似性较高的氨基 番 茄 ( Solanum lycopersicumꎬ SlERG )、 马 铃 薯
酸位于 120 ~ 414 位(图 2:C)ꎮ (Solanum tuberosumꎬStERG)、烟草( NtERG)、黄瓜
2.3 ERA 蛋白质保守结构域分析 ( Cucumis sativusꎬ CsERG)、 玉 米 ( Zea maysꎬ Zm ̄
经 NCBI 数据库 BLAST 序列比对发现ꎬPeERG DER)、水稻(OsERG1ꎬ OsERG2ꎬ OsDER)、斑马鱼
蛋白与其他物种的 ERA 蛋白具有较高的同源性ꎬ ( Danio rerioꎬ DrERA )、 小 鼠 ( Mus musculusꎬ