Page 44 - 《广西植物》2023年第9期
P. 44
1 5 9 2 广 西 植 物 43 卷
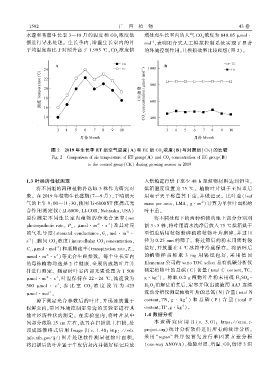
水葱和香蒲生长季 3—10 月的温度和 CO 浓度数 增处理生长室内的大气 CO 浓度为 840.05 μmol
2 2
据进行导出处理ꎮ 生长季内ꎬ增温生长室内的月 mol ꎬ表明闭合式人工模拟控制系统实现了显著
 ̄1
平均温度相比于对照升高了 1.995 ℃ ꎬCO 浓度倍 的环境控制作用ꎬ且模拟效果比较理想(图 2)ꎮ
2
图 2 2019 年生长季 ET 组空气温度(A)和 EC 组 CO 浓度(B)与对照组(CK)的比较
2
Fig. 2 Comparison of air temperature of ET group(A) and CO concentration of EC group(B)
2
to the control group(CK) during growing season in 2019
1.3 叶经济性状测定 入烘箱进行烘干至少 48 h 至植物材料达到恒重ꎬ
将不同组的两种植物各选取 3 株作为研究对 烘箱温度设置为 75 ℃ ꎮ 植物叶片烘干至恒重后
象ꎮ 在 2019 年植物生长盛期(7—9 月)ꎬ于晴朗天 用电子天平称量其干重ꎬ并做记录ꎮ 比叶重( leaf
气的上午 9:00—11:30ꎬ使用 Li ̄6800XT 便携式光 mass per areaꎬ LMAꎬ gm )计算为单位叶面积的
 ̄2
合作用测定仪( LI ̄6800ꎬLI ̄CORꎬNebraskaꎬUSA) 叶干重ꎮ
原位测定不同生长室内植物的净光 合 速 率 ( net 将不同处理下的两种植物的地上部分分别刈
photosynthetic rateꎬ P ꎬ μmolm s ) 及其对应 割 3 ~ 5 株ꎬ将叶用清水洗净后放入 75 ℃ 烘箱烘干
 ̄2
 ̄1
n
 ̄2 至恒重后用植物粉碎机将植物叶片磨碎ꎬ并过口
的气孔导度( stomatal conductanceꎬG ꎬmolm
s
 ̄1 径为 0.25 mm 的筛子ꎮ 将过筛后的粉末用密封袋
s )、胞间 CO 浓度( intercellular CO concentrationꎬ
2 2
 ̄1 装好ꎬ并放置在 4 ℃ 冰箱中冷藏保存ꎮ 将磨碎后
C ꎬμmolmol )和蒸腾速率( transpiration rateꎬT ꎬ
r
i
mmolm s )等光合生理参数ꎮ 每个生长室内 的植 物 样 品 称 取 3 mg 用 锡 纸 包 好ꎬ 采 用 德 国
 ̄1
 ̄2
的每株植物均选择 2 片健康、全展的成熟叶片并 Elementar 公司的 vario TOC select 总有机碳分析仪
排进行测定ꎮ 测定时叶室内部光强设置为 1 500 测定植物叶的总碳( C) 含量( total C contentꎬTCꎬ
 ̄1
μmolm s ꎬ叶温保持在 22 ~ 24 ℃ ꎬ流速设为 gkg )ꎮ 称取 0.2 g 植物叶片粉末用硫 H SO -
 ̄1
 ̄2
2
4
 ̄1 H O 消解法消煮后ꎬ定容并取出滤液用 AA3 连续
500 μmol s ꎬ 参 比 室 CO 浓 度 设 置 为 425 2 2
2
 ̄1 流动分析仪测定植物叶片的总氮(N) 含量( total N
μmolmol ꎮ
 ̄1
剪下测定光合参数后的叶片ꎬ并迅速放置于 contentꎬTNꎬ g kg ) 和 总 磷 ( P ) 含 量 ( total P
 ̄1
保鲜盒内ꎬ带回环境控制室旁边的实验室进行其 contentꎬTPꎬgkg )ꎮ
他叶经济性状的测定ꎮ 在实验室内ꎬ将叶片从中 1.4 数据分析
间部分截取 15 cm 左右ꎬ放置在扫描仪上扫描ꎬ处 本 该 研 究 应 用 R ( v. 3. 01ꎻ https: / / cran. r ̄
理成图像格式后用 Image J( v. 1. 48ꎻhttp: / / rsb. project.org) 统计分析软件进行所有的统计分析ꎮ
采用 “ vegan” 程 序 包 首 先 进 行 单 因 素 方 差 分 析
info.nih.gov / ij/ ) 图片处理软件测量植物叶面积ꎮ
将扫描后的叶片置于牛皮信封内并做好标记后放 (one ̄way ANOVA)ꎬ检验对照、增温、CO 倍增 3 组
2