Page 136 - 《广西植物》2025年第5期
P. 136
9 4 0 广 西 植 物 45 卷
ABA 处理 6 h 时表达量最高ꎮ 而 PhMYB8 基因在
ABA 处理 后 表 达 受 到 了 抑 制ꎮ 上 述 结 果 表 明ꎬ
PhMYB4 和 PhMYB8 均受 ABA 诱导表达ꎬ但表达
模式存在差异ꎮ
3 讨论与结论
本研究基于太子参的全长转录组数据库ꎬ通
过生物信息学方法鉴定了 15 个 R2R3 ̄MYB 转录
因子ꎬ并对其理化性质、保守基序、特征结构域及
系统 进 化 等 进 行 了 分 析ꎮ 理 化 性 质 分 析 显 示ꎬ
PhR2R3 ̄MYB 蛋白多为亲水性不稳定蛋白ꎬ这与
吴瑞等(2022)研究结果一致ꎮ 亚细胞定位结果显
示ꎬPhR2R3 ̄MYB 蛋白均定位于细胞核ꎬ这与孙爽
等(2022)研究结果一致ꎬ表明 PhR2R3 ̄MYB 基因
主要在细胞核内发挥功能ꎮ 对 PhR2R3 ̄MYB 蛋白
的特征结构域进行分析ꎬ结果显示其蛋白序列中
均 具 有 “ ̄W ̄( X19 ) ̄W ̄( X18 ) ̄W ̄” 和 “ ̄F / W ̄
(X18) ̄W ̄(X18) ̄W ̄”2 个相邻的 MYB 结构域ꎬ这
与 Gonzalez 等(2008)和叶子茂等(2023)的报道一
致ꎬ表明太子参与其他植物的 R2R3 ̄MYB 转录因
子在 DNA 结合域上具有较高的保守性ꎮ 系统进
化分析显示ꎬ太子参 R2R3 ̄MYB 蛋白可以分为 8
个亚组( C1-C8)ꎬ其中 6 个亚组成员与拟南芥中
的 R2R3 ̄MYB 转录因子有共同聚类ꎮ Cominelli 等
(2005)和樊锦涛等(2014) 研究表明ꎬ拟南芥中的
S1、S22 亚组蛋白参与植物的逆境响应及 ABA 激
素信 号 转 导 等 过 程ꎬ 而 太 子 参 中 的 PhMYB7、
PhMYB8、PhMYB9、PhMYB12 和 PhMYB13 转录因
子与之有共同聚类ꎬ因此可能也在太子参逆境响
应过程中发挥功能ꎮ
基因共表达分析是挖掘植物中与特定次级代
谢产物生物合成相关的未知基因( 包括转录因子
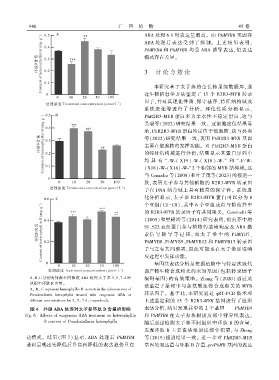
A、B、C 分别为外源不同浓度 ABA 处理太子参 3、5、7 d 后 编码基因) 的有效策略ꎮ Zhang 等(2020) 通过此
块根中环肽 B 含量ꎮ
法鉴定了茶树中与茶氨酸生物合成相关的 MYB
Aꎬ Bꎬ C represent heterophyllin B content in the tuberous root of
转录因子ꎮ 基于此ꎬ本研究通过 qRT ̄PCR 技术对
Pseudostellaria heterophylla treated with exogenous ABA at
different concentrations for 3ꎬ 5ꎬ 7 dꎬ respectively. 上述鉴定到的 15 个 R2R3 ̄MYB 基因进行了组织
图 6 外源 ABA 处理对太子参环肽 B 含量的影响 表达分析ꎬ结果发现其中的 2 个基因———PhMYB4
Fig. 6 Effects of exogenous ABA treatment on heterophyllin 和 PhMYB8 在太子参块根韧皮部中特异性表达ꎮ
B content of Pseudostellaria heterophylla
随后通过检测太子参不同组织中环肽 B 的含量ꎬ
发现环肽 B 主要在块根韧皮部中积累ꎬ与 Zheng
达模式ꎮ 结果( 图 7) 显示ꎬABA 处理后 PhMYB4 等(2019)报道结果一致ꎮ 进一步对 PhR2R3 ̄MYB
基因呈现出先降低后升高再降低的表达趋势且在 基因的表达量与环肽 B 含量、prePhHB 基因的表达