Page 126 - 《广西植物》2023年第2期
P. 126
3 2 0 广 西 植 物 43 卷
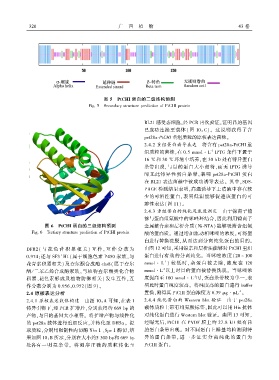
图 5 PtCHI 蛋白的二级结构预测
Fig. 5 Secondary structure prediction of PtCHI protein
BL21 感受态细胞ꎬ经 PCR 再次验证ꎬ证明目的基因
已成功连接至载体( 图 10:C)ꎮ 这说明获得了含
pet28a ̄PtCHI 重组质粒的原核表达菌株ꎮ
2.4.2 重组蛋白诱导表达 将含有 pet28a ̄PtCHI 重
组质粒的菌株ꎬ在 0.5 mmolL IPTG 条件下置于
 ̄1
16 ℃ 和 30 ℃ 环境中培养ꎬ在 30 kD 处有特异蛋白
条带出现ꎬ与目的蛋白大小相符ꎬ而无 IPTG 诱导
时无此特异性蛋白条带ꎬ表明 pet28a ̄PtCHI 蛋白
在 BL21 表达菌株中被成功诱导表达ꎮ 其中ꎬSDS ̄
PAGE 检测结果表明ꎬ高温诱导下上清液中存在较
少的可溶性蛋白ꎬ表明低温能够促进该蛋白的可
溶性表达(图 11)ꎮ
2.4.3 重组蛋白的纯化及浓度测定 由于镍离子能
够与蛋白组氨酸中的咪唑环结合ꎬ因此利用镍离子
图 6 PtCHI 蛋白的三级结构预测 金属螯合亲和层析介质(Ni ̄NTA) 能够吸附含组氨
Fig. 6 Tertiary structure prediction of PtCHI protein 酸的蛋白质ꎮ 通过增加流动相咪唑的浓度ꎬ可将蛋
白进行替换洗脱ꎬ从而达到分离纯化蛋白的目的ꎮ
DFR2( 与 花 色 苷 积 累 相 关) 互 作ꎬ 互 作 分 数 为 由图 12 可知ꎬ采用镍亲和层析法能够对 PtCHI 重组
0.974ꎻ还与 SF3’H1(属于细胞色素 P450 家族ꎬ与 蛋白进行有效的分离纯化ꎮ 当咪唑浓度(20 ~ 100
 ̄1
花青素积累相关)及查尔酮合成酶 chs8( 属于查尔 mmol L ) 较 低 时ꎬ 杂 蛋 白 被 去 除ꎬ 浓 度 在 120
 ̄1
酮 / 二苯乙烯合成酶家族ꎬ与植物查尔酮类化合物 mmolL 以上时目的蛋白被替换洗脱ꎮ 当咪唑浓
 ̄1
积累、花色素形成及植物防御相关) 发生互作ꎬ互 度提高至 160 mmolL 时ꎬ蛋白条带较为单一ꎬ表
作分数分别为 0.956、0.952(图 9)ꎮ 明此时蛋白纯度较高ꎮ 将纯度高的蛋白进行 buffer
 ̄1
2.4 原核表达分析 置换ꎬ测得其 PtCHI 蛋白浓度为 6.39 μgμL ꎮ
2.4.1 原核表达载体构建 由图 10:A 可知ꎬ在表 1 2.4.4 纯化蛋白的 Western blot 验证 由于 pet28a
特异引物下ꎬ经 PCR 扩增后ꎬ分别获得约 669 bp 的 载体质粒上带有组氨酸标签ꎬ因此可以用 His 抗体
产物ꎬ与目的基因大小相符ꎮ 将扩增产物与线性化 对纯化蛋白进行 Western blot 验证ꎮ 由图 13 可知ꎬ
的 pet28a 载体进行重组反应ꎬ并转化至 DH5αꎮ 提 经曝光后ꎬPtCHI 在 PVDF 膜上约 27.8 kD 处有目
取质粒ꎬ分别用限制性内切酶 XhoⅠ、SpeⅠ酶切ꎬ结 的蛋白条带出现ꎮ 对不同蛋白上样量均检测到特
果如图 10:B 所示ꎬ分别在大小约5 300 bp和 669 bp 异的蛋 白 条 带ꎬ 进 一 步 证 实 分 离 纯 化 的 蛋 白 为
处各有一 明 亮 条 带ꎮ 将 测 序 正 确 的 质 粒 转 化 至 PtCHI 蛋白ꎮ