Page 24 - 《广西植物》2020年第1期
P. 24
2 0 广 西 植 物 40 卷
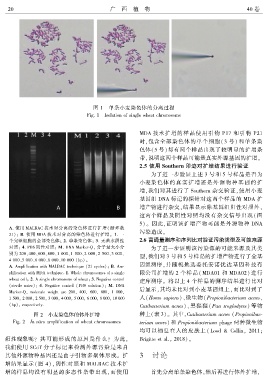
图 1 单条小麦染色体的分离过程
Fig. 1 Isolation of single wheat chromosome
MDA 技术扩增的样品使用引物 P17 和引物 P21
时ꎬ包含全部染色体的单个细胞(3 号) 和单条染
色体(5 号)却有两个样品出现了较明显的扩增条
带ꎬ说明这两个样品可能是真实外源基因的扩增ꎮ
2.5 使用 Southern 印迹对扩增结果进行验证
为了进一步验证上述 3 号和 5 号样品是否为
小麦染色体的真实扩增还是外源物种基因的扩
增ꎬ我们对其进行了 Southern 杂交验证ꎬ使用小麦
基因组 DNA 标记的探针对这两个样品的 MDA 扩
增产物进行杂交ꎬ结果显示除基因组阳性对照外ꎬ
这两个样品及阴性对照均没有杂交信号出现( 图
5)ꎮ 因此ꎬ证明该扩增产物可能是外源物种 DNA
A. 使用 MALBAC 技术对分离的染色体进行扩增( 循环数
21)ꎻ B. 使用 MDA 技术对分离的染色体进行扩增ꎮ 1. 一 污染造成ꎮ
个完整细胞的全部染色体ꎻ 2. 单条染色体ꎻ 3. 无菌水阴性 2.6 高通量测序和序列比对验证污染类型及可能来源
对照ꎻ 4. PBS 阴性对照ꎻ M. DNA Marker ̄Qꎬ 分子量大小分 为了进一步证明该污染源的可能来源及其类
别为 200、400、600、800、1 000、1 500、2 000、2 500、3 000、
型ꎬ我们对 3 号和 5 号样品的扩增产物进行了全基
4 000、5 000、6 000、8 000、10 000 (bp)ꎮ
因组测序ꎬ并随机挑选委托安诺优达基因科技有
A. Amplification with MALBAC technique (21 cycles)ꎻ B. Am ̄
plification with MDA technique. 1. Whole chromosomes of a single 限公司扩增的 2 个样品( MDA01 和 MDA02) 进行
wheat cellꎻ 2. A single chromosome of wheatꎻ 3. Negative control 建库测序ꎮ 将以上 4 个样品的测序结果进行比对
(sterile water)ꎻ 4. Negative control (PBS solution)ꎻ M. DNA
后显示ꎬ其均未比对到小麦基因组上ꎬ而比对到了
Marker ̄Qꎬ molecule weight are 200ꎬ 400ꎬ 600ꎬ 800ꎬ 1 000ꎬ
1 500ꎬ 2 000ꎬ 2 500ꎬ 3 000ꎬ 4 000ꎬ 5 000ꎬ 6 000ꎬ 8 000ꎬ 10 000 人(Homo sapiens)、微生物(Propionibacterium acnes、
(bp)ꎬ respectively. Cutibacterium acnes)、黑猩猩( Pan troglodytes) 等物
图 2 小麦染色体的体外扩增 种上(表 3)ꎮ 其中ꎬCutibacterium acnes (Propionibac ̄
Fig. 2 In vitro amplification of wheat chromosomes terium acnes) 和 Propionibacterium phage 两种微生物
均可以栖息在人的皮肤上( Lood & Collinꎬ 2011ꎻ
阳性现象呢? 其可能形成的原因是什么? 为此ꎬ Brigitte et al.ꎬ 2018)ꎮ
我们使用 SCoT 分子标记来检测外源污染是来自
其他外源物种基因还是由于引物多聚体形成ꎮ 扩 3 讨论
增结果显示( 图 4)ꎬ阴性对照和 MALBAC 技术扩
增的样品均没有明显的多态性条带出现ꎬ而使用 首先分离单条染色体ꎬ然后再进行体外扩增ꎬ