Page 87 - 《广西植物》2023年第10期
P. 87
10 期 邓颢珂等: 海三棱藨草及其近缘种基因组大小的测定 1 8 4 1
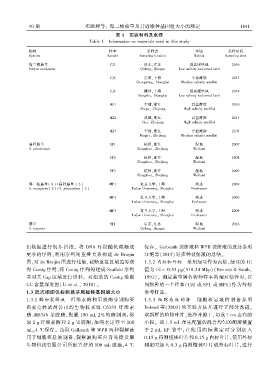
表 1 实验材料及来源
Table 1 Information on materials used in this study
物种 样本 采样点 生境 采样时间
Species Sample Sampling location Habitat Sampling time
海三棱藨草 CJ1 启东ꎬ江苏 低盐围垦地 2016
Scirpus mariqueter Qidongꎬ Jiangsu Low salinity raclaimed land
CJ2 崇明ꎬ上海 中盐滩涂 2013
Chongmingꎬ Shanghai Medium salinity mudflat
CJ3 横沙ꎬ上海 低盐围垦地 2014
Hengshaꎬ Shanghai Low salinity raclaimed land
HZ1 乍浦ꎬ浙江 高盐滩涂 2016
Zhapuꎬ Zhejiang High salinity mudflat
HZ2 慈溪ꎬ浙江 高盐滩涂 2015
Cixiꎬ Zhejiang High salinity mudflat
HZ3 宁波ꎬ浙江 中盐滩涂 2105
Ningboꎬ Zhejiang Medium salinity mudflat
扁秆藨草 SP1 杭州ꎬ浙江 湿地 2007
S. planiculmis Hangzhouꎬ Zhejiang Wetland
SP2 杭州ꎬ浙江 湿地 2008
Hangzhouꎬ Zhejiang Wetland
SP3 杭州ꎬ浙江 湿地 2009
Hangzhouꎬ Zhejiang Wetland
海三棱藨草(♀) ×扁秆藨草 (♂) MP1 复旦大学ꎬ上海 淡水 2009
S. mariqueter(♀) ×S. planiculmis (♂) Fudan Universityꎬ Shanghai Freshwater
MP2 复旦大学ꎬ上海 淡水 2009
Fudan Universityꎬ Shanghai Feshwater
MP3 复旦大学ꎬ上海 淡水 2009
Fudan Universityꎬ Shanghai Freshwater
藨草 ST1 启东ꎬ江苏 湿地 2016
S. triqueter Qidongꎬ Jiangsu Wetland
组数据进行初步拼接ꎮ 将 DNA 片段随机截断成 保存ꎮ Galbraith 裂解液和 WPB 裂解液的成分参照
更小的序列ꎬ利用序列间重叠关系构建 de Bruijin 汪艳等(2015)对多种裂解液的总结ꎮ
图ꎬ对 de Bruijin 图进行化简ꎬ截断重复区域边界获 1.3.2 内标和外标 采用绿豆作为内标ꎬ绿豆的 1C
得 Contig 序列ꎬ将 Contig 序列构建成 Scaffold 序列 值为 1C = 0.53 pg(518.34 Mbp)(Bennett & Smithꎬ
并对其 Gap 区域进行填补ꎮ 对组装的 Contig 绘制 1991)ꎮ 测定藨草属各物种样本的相对倍性时ꎬ以
GC 含量深度图(Li et al.ꎬ 2010)ꎮ 同物种的一个样本(CJ1 或 SP1 或 MP1) 作为外标
1.3 流式细胞仪检测藨草属植物基因组大小 参考样品ꎮ
1.3.1 酶和裂解液 纤维素酶和果胶酶分别购买 1.3.3 细 胞 悬 液 制 备 细 胞 核 悬 液 的 制 备 参 照
自麦克林试剂公司的生物技术级 C6339 纤维素 Dolezel 等(2003) 的实验方法并进行了部分改进ꎮ
酶、M6346 果胶酶ꎬ配置 100 mL 2% 的酶制剂:称 取新鲜的植物叶片ꎬ洗净并擦干ꎬ切成 1 cm 左右的
取 2 g 纤维素酶和 2 g 果胶酶ꎬ加纯水定容至 100 小段ꎮ 取 1.5 mL 预先配置的混合均匀的酶溶液置
mLꎬ4 ℃ 保存ꎮ 选取 Galbraith 和 WPB 两种裂解液 于 2 mL EP 管 中ꎻ 在 使 用 内 标 测 定 时 分 别 加 入
用于细胞核悬液制备ꎬ裂解液购买自青岛捷世康 0.15 g 待测植株叶片和 0.15 g 内标叶片ꎬ使用外标
生物科技有限公司所配置好的 100 mL 成液ꎬ4 ℃ 测定时加入 0.3 g 待测植株叶片或外标叶片ꎬ进行