Page 20 - 《广西植物》2024年第2期
P. 20
2 2 2 广 西 植 物 44 卷
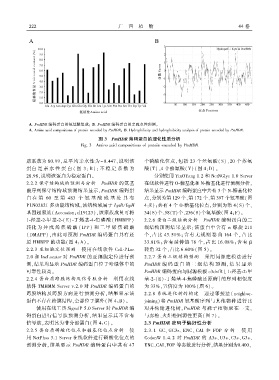
A. PmHDR 编码蛋白的氨基酸组成ꎻ B. PmHDR 编码蛋白的亲疏水性预测ꎮ
A. Amino acid compositions of protein encoded by PmHDRꎻ B. Hydrophilicity and hydrophobicity analysis of protein encoded by PmHDR.
图 3 PmHDR 编码蛋白的理化性质分析
Fig. 3 Amino acid compositions of protein encoded by PmHDR
肪系数为 80.99ꎬ总平均亲水性为- 0.447ꎬ说明该 个磷酸化位点ꎬ包括 23 个丝氨酸( S)、20 个苏氨
蛋白 是 亲 水 性 蛋 白 ( 图 3: B)ꎻ 不 稳 定 系 数 为 酸(T)、4 个酪氨酸(Y)(图 4:D)ꎮ
28.98ꎬ说明该蛋白为稳定蛋白ꎮ 分别使用 YinOYang 1.2 和 NetNGlyc 1.0 Server
2.2.2 保守结构域的预测与分析 PmHDR 的氨基 在线软件进行 O ̄糖基化和 N ̄糖基化进行预测分析ꎬ
酸序列保守结构域预测结果显示ꎬPmHDR 编码蛋 结果显示 PmHDR 编码蛋白中共有 3 个 N ̄糖基化位
白 在 第 60 至 第 483 个 氨 基 酸 残 基 处 具 有 点ꎬ分别为第 129 个、第 172 个、第 397 个氨基酸(图
PLN02821 多功能结构域ꎬ该结构域属于 LytB / IspH 4:E)ꎻ共有 4 个 O ̄糖基化位点ꎬ分别为第 4(S) 个、
基因超家族(Accession:cl19123)ꎬ该家族成员可将 34(S)个、58(T)个、236(S)个氨基酸(图 4:F)ꎮ
1 ̄羟基 ̄2 ̄甲基 ̄2 ̄( E) ̄丁烯基 ̄4 ̄焦磷酸( HMBPP) 2.2.6 蛋白二级结构分析 PmHDR 编码蛋白的二
转化 为 异 戊 烯 焦 磷 酸 ( IPP ) 和 二 甲 烯 焦 磷 酸 级结构预测结果显示:该蛋白中含有 α 螺旋 211
(DMAPP)ꎬ由此可预测 PmHDR 编码蛋白具有还 个ꎬ占比 43. 51%ꎻ含 有 无 规 则 卷 曲 164 个ꎬ 占 比
原 HMBPP 的功能(图 4:A)ꎮ 33.81%ꎻ含有延伸链 78 个ꎬ占比 16.08%ꎻ含有 β
2.2.3 亚细胞定位预测 使用在线软件 Cell ̄PLoc 转角 32 个ꎬ占比 6.60%(图 5)ꎮ
2.0 和 IncLocator 对 PmHDR 的亚细胞定位进行预 2.2.7 蛋白三级结构预测 采用同源建模法进行
测ꎬ结果均显示 PmHDR 编码蛋白位于叶绿体中的 PmHDR 编 码 蛋 白 的 三 级 结 构 预 测ꎬ 结 果 显 示
可靠性较高ꎮ PmHDR 编码蛋白与同源模板 c3dnfB [1 ̄羟基 ̄2 ̄甲
2.2.4 蛋白质跨膜结构及信号肽分析 利用在线 基 ̄2 ̄(E) ̄丁烯基 ̄4 ̄焦磷酸还原酶] 的序列相似度
软件 TMHMM Server v.2.0 对 PmHDR 编码蛋白的 为 33%ꎬ置信度为 100%(图 6)ꎮ
跨膜结构及跨膜方向进行预测分析ꎬ结果显示该 2.2.8 系统进化树的构建 通过邻接法( neighbor ̄
蛋白不存在跨膜结构ꎬ全部位于膜外(图 4:B)ꎮ joining)将 PmHDR 氨基酸序列与其他物种进行比
使用在线工具 SignalP 5.0 Server 对 PmHDR 编 对并构建进化树ꎬPmHDR 与裸子植物聚在一支ꎬ
码蛋白进行信号肽预测分析ꎬ结果显示其不含有 与赤松、火炬松同源性更高(图 7)ꎮ
信号肽ꎬ表明其为非分泌蛋白(图 4:C)ꎮ 2.3 PmHDR 密码子偏好性分析
2.2.5 蛋白质磷酸化位点和糖基化位点分析 使 2.3. 1 GC、 GC3s、 ENC、 CAI 和 FOP 分 析 使 用
用 NetPhos 3.1 Server 在线软件进行磷酸化位点的 CodonW 1. 4. 2 对 PmHDR 的 A3s、 U3s、 C3s、 G3s、
预测分析ꎬ结果显示 PmHDR 编码蛋白中共有 47 ENC、CAI、FOP 等参数进行分析ꎬ结果分别为0.400、